บทที่2 อะตอมและสมบัติของธาตุ
2.1แบบจำลองอะตอม
2.1.1 แบบจำลองอะตอมของดอลตัน
ในปีพ.ศ 2346 จอห์นดอลตัน นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอมเพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของมวลของสารก่อนและหลังทำปฏิกิริยาเคมีรวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบหนึ่งหนึ่งซึ่งมีสาระสำคัญดังนี้1.ประกอบด้วยอนุภาคขนาดเล็กๆเหล่านี้เรียกว่าอะตอมซึ่งแบ่งแยกและทำให้สูญหายไม่ ได้
2.อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกันเช่นมีมวลเท่าแต่จะมีสมบัติแตกต่างจาก อะตอมของธาตุอื่น
3.สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
2.1.2 แบบจำลองอะตอมของทอมสัน
เซอร์ โจเซฟ จอห์น ทอมสัน (J.J Thomson) นักวิทยาศาสตร์ชาวอังกฤษได้สนใจปรากฏการณ์ที่เกิดขึ้นในหลอดรังสีแคโทด จึงทำการทดลองเกียวกับการนำไฟฟ้าของแก๊สขึ้นในปี พ.ศ. 2440 (ค.ศ. 1897) และได้สรุปสมบัติของรังสีไว้หลายประการ ดังนี้
- รังสีแคโทดเดินทางเป็นเส้นตรงจากขั้วแคโทดไปยังขั้วแอโนด เนื่องจากรังสีแคโทดทำให้เกิดเงาดำของวัตถุได้ ถ้านำวัตถุไปขวางทางเดินของรังสี
- รังสีแคโทดเป็นอนุภาคที่มีมวล เนื่องจากรังสีทำให้ใบพัดที่ขวางทางเดินของรังสีหมุนได้เหมือนถูกลมพัด
- รังสีแคโทดประกอบด้วยอนุภาคที่มีประจุลบ เนื่องจากเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า
จากผลการทดลองนี้ ทอมสันอธิบายได้ว่า อะตอมของโลหะที่ขั้วแคโทดเมื่อได้รับกระแสไฟฟ้าที่มีความต่างศักย์สูงจะปล่อยอิเล็กตรอนออกมาจากอะตอม อิเล็กตรอนมีพลังงานสูง และเคลื่อนที่ภายในหลอด ถ้าเคลื่อนที่ชนอะตอมของแก๊สจะทำให้อิเล็กตรอนในอะตอมของแก๊สหลุดออกจากอะตอม อิเล็กตรอนจากขั้วแคโทดและจากแก๊สซึ่งเป็นประจุลบจะเคลื่อนที่ไปยังขั้วแอโนด ขณะเคลื่อนที่ถ้ากระทบฉากที่ฉาบสารเรืองแสง เช่น ZnS ทำให้ฉากเกิดการเรืองแสง ซึ่งทอมสันสรุปว่ารังสีแคโทดประกอบด้วยอนุภาคที่มีประจุลบเรียกว่า “อิเล็กตรอน” และยังได้หาค่าอัตราส่วนประจุต่อมวล (e/m) ของอิเล็กตรอนโดยใช้สยามแม่เหล็กและสนามไฟฟ้าช่วยในการหา ซึ่งได้ค่าประจุต่อมวลของอิเล็กตรอนเท่ากับ 1.76 x 108 C/g ค่าอัตราส่วน e/m นี้จะมีค่าคงที่ ไม่ขึ้นอยู่กับชนิดของโลหะที่เป็นขั้วแคโทด และไม่ขึ้นอยู่กับชนิดของแก๊สที่บรรจุอยู่ในหลอดรังสีแคโทด แสดงว่าในรังสีแคโทดประกอบด้วยอนุภาคไฟฟ้าที่มีประจุลบเหมือนกันหมดคือ อิเล็กตรอน นั่นเอง ทอมสันจึงสรุปว่า
“อิเล็กตรอนเป็นส่วนประกอบส่วนหนึ่งของอะตอม และอิเล็กตรอนของทุกอะตอมจะมีสมบัติเหมือนกัน’’
ทอมสันได้วิเคราะห์การทดลองของโกลด์ ชไตน์ และการทดลองของทอมสัน จึงเสนอแบบจำลองอะตอมว่า
“อะตอมเป็นรูปทรงกลมประกอบด้วยเนื้ออะตอมซึ่งมีประจุบวกและมีอิเล็กตรอนซึ่งมีประจุลบกระจายอยู่ทั่วไป อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ”
แบบจำลองอะตอมของทอมสัน
อะตอม ประกอบด้วย อนุภาคโปรตอนและอิเล็กตรอนกระจายอยู่ทั่วไปอย่างสม่ำเสมอ อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับประจุลบ
2.1.3 แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอมจะประกอบด้วยนิวเคลียสที่มีโปรตอนและนิวตรอนรวมตัวกันอยู่อย่างหนาแน่นอยู่ตรงกลางนิวเคลียสมีขนาดเล็กมากมีมวลมาก และมีประจุบวกส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบและมีมวลน้อยมาก จะวิ่งรอบนิวเคลียสเป็นวงกว้าง การค้นพบนิวตรอน เนื่องจากมวลของอะตอมส่วนใหญ่อยู่ที่นิวเคลียสซึ่งเป็นมวลของโปรตอนแต่โปรตอนมีมวลประมาณครึ่งหนึ่งของนิวเคลียสเท่านั้น แสดงว่าต้องมีอนุภาคซึ่งไม่มีประจุไฟฟ้าแต่มีมวลใกล้เคียงกับโปรตอนอยู่ในอะตอมด้วย เจมส์ แชวิก นักวิทยาศาสตร์ชาวอังกฤษ จึงศึกษาทดลองเพิ่มเติมจนพบนิวตรอนซึ่งเป็นกลางทางไฟฟ้า อะตอมของธาตุทุกชนิดในโลกจะมีนิวตรอนเสมอ ยกเว้นอะตอมของไฮโดรเจนในรูปของไอโซโทป
สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง
2.1.4 แบบจำลองอะตอมของโบร์
นักวิทยาศาสตร์ได้พยายามศึกษาลักษณะของการจัดอิเล็กตรอนรอบๆ อะตอม โดยแบ่งการศึกษาออกเป็น 2 ส่วน ส่วนแรกเป็นการศึกษษเกี่ยวกับสเปกตรัมของอะตอม ซึ่งทำให้ทราบว่าภายในอะตอมมีการจัดระดับพลังงานเป็นชั้นๆ ในแต่ละชั้นจะมีอิเล็กตรอนบรรจุอยู่ ส่วนที่สองเป็นการศึกษาเกี่ยวกับพลังงานไอโอไนเซชัน เพื่อดูว่าในแต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุอยู่ได้กี่ตัว
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้น ที่มีความยาวคลื่นต่างๆเรียงลำดับกันไป
นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา สรุปได้ดังนี้
1 . อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆ ตามระดับพลังงาน และแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว
2. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุดยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น ระดับพลังงานจะยิ่งสูงขึ้น
3. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2, n = 3,... ตามลำดับ หรือเรียกเป็นชั้น K , L , M , N ,O , P , Q ....
เป็นแบบจำลองที่นักวิทยาศาสตร์คิดว่าเป็นไปได้มากที่สุดทั้งนี้ได้จากการประมวลผลการทดลองและข้อมูลต่างๆ อะตอมภายหลังจากที่นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา อาจสรุปได้ดังนี้
1. อิเล็กตรอนไม่สามารถวิ่งรอบนิวเคลียสด้วยรัศมีที่แน่นอน บางครั้งเข้าใกล้บางครั้งออกห่าง จึงไม่สามารถบอกตำแหน่งที่แน่นอนได้ แต่ถ้าบอกได้แต่เพียงที่พบอิเล็กตรอนตำแหน่งต่างๆภายในอะตอมและอิเล็กตรอนที่เคลื่อนที่เร็วมากจนเหมือนกับอิเล็กตรอนอยู่ทั่วไป ในอะตอมลักษณะนี้เรียกว่า " กลุ่มหมอก"
2. กลุ่มหมอกของอิเล็กตรอนในระดับพลังงานต่างๆจะมีรูปทรงต่างกันขึ้นอยู่กับจำนวนอิเล็กตรอน และระดับพลังงานอิเล็กตรอน
3. กลุ่มหมอกที่มีอิเล็กตรอนระดับพลังงานต่ำจะอยู่ใกล้นิวเคลียสส่วนอิเล็กตรอนที่มีระดับพลังงานสูงจะอยู่ไกลนิวเคลียส
4. อิเล็กตรอนแต่ละตัวไม่ได้อยู่ในระดับพลังงานใดพลังงานหนึ่งคงที่
5. อะตอมมีอิเล็กตรอนหลายๆระดับพลังงาน
2.2 อนุภาคในอะตอมและไอโซโทป
2.2.1 อนุภาคในอะตอม
อนุภาค | สัญลักษณ์ | ประจุ(คูลอมบ์) | น้ำหนัก(กิโลกรัม) |
โปรตอน | p | +1.60x10-19 | 1.67x10-27 |
นิวตรอน | n | ไม่มีประจุ | 1.67x10-27 |
อิเล็กตรอน | e- | -1.60x10-19 | 9.11x10-31 |
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
2.2.2เลขอะตอม เลขมวล และไอโซโทป
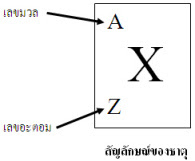
เลขอะตอม คือ จำนวนโปรตอนในนิวเคลียสของแต่ละอะตอมของธาตุ ในอะตอมที่เป็นกลางจะมีจำนวนโปรตอนเท่ากับจ้านวนอิเล็กตรอน
เลขมวล คือ ผลรวมของนิวตรอนและโปรตอนที่มีในนิวเคลียสของอะตอมของธาตุ นิวเคลียสในอะตอมอื่นๆ
ทั้งหมดจะมีทั้งโปรตอนและนิวตรอนอยู่
ไอโซโทป (isotope) หมายถึง อะตอมของธาตุชนิดเดียวกันที่มีเลขอะตอม (Z) เท่ากัน แต่เลขมวล (A) ไม่เท่ากัน
2.3 การจัดเรียงอิเล็กตรอนในอะตอม
2.3.1 จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
จากการศึกษาสเปกตรัมของธาตุต่างๆ พบว่าในระดับพลังงานหลัก (n) ยังประกอบด้วยระดับพลังงานย่อยหรือเรียกว่า ซับเซลล์โดยกำหนดเป็นสัญลักษณ์คือ s p d และ f ซึ่งในแต่ละระดับพลังงานย่อยจะมีอิเล็กตรอนได้ไม่เท่ากันและมีพลังงานไม่เท่ากัน
2.3.2 ระดับพลังงานหลัก และระดับพลังงานย่อย
อิเล็กตรอนในอะตอมที่อยู่ ณ ระดับพลังงาน จะมีพลังงานจำนวนหนึ่ง ส้าหรับอิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะมีพลังงานน้อยกว่าพวกที่อยู่ไกลออกไป ยิ่งอยู่ไกลมากยิ่งมีพลังงานมากขึ้น
2.3.3 ออร์บิทัล
ในการจัดอิเล็กตรอนอาจเขียนเป็นแผนภาพออร์บิทัลซึ่งแสดงสของอิเล็กตรอนด้วย ดังตัวอย่าง C มี z = 6 มีโครงแบบอิเล็กตรอนเป็น 1s2 2s2 2p2 ในการบรรจุอิเล็กตรอนหรือการจัดเรียงอิเล็กตรอนลงในออร์บิทัลจะต้องยึดหลักในการบรรจุอิเล็กตรอนของอะตอมหนึ่งๆ ลงในออร์บิทัลที่เหมาะสมตามหลัก
2.3.4 หลักการจัดเรียงอิเล็กตรอนในอะตอม
2.4 ตารางธาตุและสมบัติของธาตุหมู่หลัก
2.4.1 วิวัฒนาการของการสร้างตารางธาตุ
2.4.2 กลุ่มของธาตุในตารางธาตุ
ตามสมบัติทางกายภาพและทางเคมี เรายังสามารถแบ่งธาตุออกได้เป็นสามส่วนใหญ่ ๆ ได้แก่ โลหะ กึ่งโลหะ และอโลหะ ธาตุโลหะส่วนใหญ่จะสะท้อนแสง อยู่ในรูปอัลลอย และยังสามารถทำปฏิกิริยากับธาตุอโลหะ (ยกเว้น แก๊สมีตระกูล) ได้สารประกอบไอออนิกในรูปของเกลือ ส่วนธาตุอโลหะส่วนใหญ่จะเป็นแก๊สซึ่งไม่มีสีหรือมีสี อโลหะที่ทำปฏิกิริยากับอโลหะด้วยกันจะทำให้เกิดสารประกอบที่มีพันธะโควาเลนต์ ระหว่างธาตุโลหะกับธาตุอโลหะ คือธาตุกึ่งโลหะ ซึ่งจะมีสมบัติของธาตุโลหะและอโลหะผสมกัน
2.4.3ขนาดอะตอม
2.4.5 พลังงานไอออไนเซชัน
2.4.6 สัมพรรคภาพอิเล็กตรอน
2.4.7 อิเล็กโทรเนกาติวิตี
2.5 ธาตุแทรนซิชัน
2.6 ธาตุกัมมันตรังสี
2.6.1 การเกิดกัมมันตภาพรังสี
2.6.2 การสลายตัวของไอโซโทปกัมมันตรังสี
การสลายตัวของธาตุกัมมันตรังสี คือการที่ธาตุกัมมันตรังสีมีปลดปล่อยกัมมันตภาพรังสีออกมา จะมีเปลี่ยนแปลงเกิดขึ้นภายในนิวเคลียส ซึ่งการเปลี่ยนแปลงนี้บางครั้งจะมีธาตุใหม่เกิดขึ้น บางครั้งไม่มีธาตุใหม่เกิดขึ้น
1. เมื่อสลายตัวให้รังสีแอลฟา
ในการสลายตัวให้รังสีแอลฟา จะพบว่าได้ธาตุใหม่เกิดขึ้น โดยธาตุใหม่ที่เกิดขึ้นจะมีเลขมวลลดลง 4 และเลขอะตอมลดลง 2
2. เมื่อสลายตัวให้รังสีเบตา
3. เมื่อสลายตัวให้รังสีแกมมา การสลายตัวให้รังสีแกมมาจะพบว่า ไม่มีธาตุใหม่เกิดขึ้น ยังได้ธาตุเดิม
แต่มีพลังงานที่ลดลง ( ไม่มีดอกจัน ธาตุที่มีดอกจันกำกับแสดงว่ามีพลังงานสูง).การสลายตัวของธาตุกัมมันตรังสี แบ่งพิจารณาได้ดังนี้


















ไม่มีความคิดเห็น:
แสดงความคิดเห็น