บทที่3 พันธะเคมี
3.1สัญลักษณ์แบบจุดของลิวอิสและกฎออกเตต
สัญลักษณ์แบบจุดของลิวอิส
สูตรโครงสร้างของลิวอิส เป็นสูตรโครงสร้างที่กิลเบิร์ต ลิวอิสได้คิดค้นขึ้นมาเพื่อใช้ในการอธิบายรูปร่างโมเลกุล ซึ่งจะแบ่งได้เป็น 2 ประเภทได้แก่
-สูตรโครงสร้างส่วนที่เป็นจุด เป็นสูตรโครงสร้างที่ใช้จุดแทนอิเล็กตรอนวงนอกสุดของอะตอมที่เกิดพันธะ โดยให้อิเล็กตรอนครบตามกฎออกเตต ยกเว้นบางธาตุซึ่งมีการยกเว้นได้
-สูตรโครงสร้างส่วนที่เป็นเส้น เป็นสูตรโครงสร้างที่ใช้เส้นและจุดแทนอิเล็กตรอนวงนอกสุดของอะตอมที่เกิดพันธะ ซึ่งเส้น 1 เส้นจะแทนอิเล็กตรอน 2 ตัวหรือ 1 คู่ การเขียนสูตรโครงสร้างใน
-ลักษณะนี้จะแสดงอิเล็กตรอนคู่โดดเดี่ยวด้วยหรือไม่ก็ได้
กฎออกเตต
กฎออกเตตคือกฎที่อะตอมพยายามที่จะทำให้เวเลนซ์อิเล็กตรอนของตัวมันเองให้ครบแปดซึ่งเป็นสภาพที่เสถียรที่สุด
3.2พันธะไอออนิก
พันธะไอออนิก ( Ionic bond ) หมายถึง แรงยึดเหนี่ยวที่เกิดในสารประกอบที่เกิดขึ้นระหว่าง 2 อะตอมอะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีน้อยจะให้อิเล็กตรอนแก่อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีมาก และทำให้อิเล็กตรอนที่อยู่รอบๆ อะตอมครบ 8 ( octat rule ) กลายเป็นไอออนบวก และไอออนลบตามลำดับ เกิดแรงดึงดูดทางไฟฟ้าระหว่างไอออนบวกและไอออนลบ และเกิดเป็นโมเลกุลขึ้น เช่น การเกิดสารประกอบ NaCl
สมบัติของสารประกอบไอออนิก
3.3 พันธะโคเวนเลนต์
พันธะโคเวเลนต์ คือพันธะที่เกิดขึ้นอันเนื่องมาจากอะตอม 2 อะตอมนำอิเล็กตรอนมาใช้ร่วมกัน (โดยทั่วไปแล้วหมายถึงอะตอมของธาตุหมู่ IVA, VA, VIA และ VII )
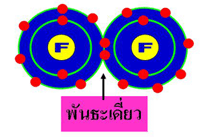
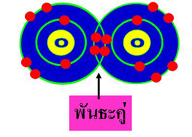
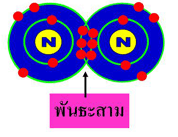
กระบวนการเกิดพันธะโคเวเลนต์อธิบายได้ดังรูป
จากรูปแสดงการนำอิเล็กตรอนของ Fแต่ละอะตอมมาใช้ร่วมกันเดิม Fแต่ละอะตอมมีเวเลนซ์อิเล็กตรอนเท่ากับ 7 แต่หลังจากการใช้อิเล็กตรอนร่วมกันเกิดเป็น F2 แต่ละอะตอมของ F จะมีเวเลนซ์อิเล็กตรอนเท่ากับแปดซึ่งเป็นไปตามกฎออกเตต ดังนั้นจะเห็นว่า F อะตอมนิยมสร้างพันธะเกิดเป็น F2 เพราะทำให้อะตอมที่นำอิเล็กตรอนมาใช้ร่วมกันเป็นไปตามกฎออกเตตซึ่งทำให้โมเลกุลที่เกิดขึ้นมีค่าพลังงานลดลงทำให้ความเสถียรมากขึ้น
3.4 พันธะโลหะ
พันธะโลหะ (อังกฤษ: Metallic bonding) เป็นพันธะภายในโลหะซึ่งเกี่ยวข้องกับ การเคลื่อนย้าย อิเล็กตรอน อิสระระหว่างแลตทิซของอะตอมโลหะ ดังนั้นพันธะโลหะจึงอาจเปรียบได้กับเกลือที่หลอมเหลวอะตอมของโลหะมีอิเล็กตรอนพิเศษเฉพาะในวงโคจรชั้นนอกของมันเทียบกับคาบ (period) หรือระดับพลังงานของพวกมัน อิเล็กตรอนที่เคลื่อนย้ายเหล่านี้เปรียบได้กับทะเลอิเล็กตรอน(Sea of Electrons) ล้อมรอบแลตทิชขนาดใหญ่ของไอออนบวก ยังไม่สามารถเขียนเป็นสูตรทางเคมีได้ เพราะไม่ทราบจำนวนอะตอมที่แท้จริง พันธะโลหะอาจจะมีเป็นล้าน ๆ อะตอมก็ได้
พันธะโลหะเทียบได้กับพันธะโควาเลนต์ที่เป็น นอน-โพลาร์ ที่จะไม่มีในธาตุโลหะบริสุทธ์ หรือมีน้อยมากในโลหะผสม ความแตกต่าง อิเล็กโตรเนกาทิวิตีระหว่างอะตอม ซึ่งมีส่วนในปฏิกิริยาพันธะ และอิเล็กตรอนที่เกี่ยวข้องในปฏิกิริยาจะเคลื่อนย้ายข้ามระหว่างโครงสร้างผลึกของโลหะ
พันธะโลหะเป็นแรงดึงดูดไฟฟ้าสถิต (electrostatic attraction) ระหว่างอะตอม หรือไออนของโลหะ และอิเล็กตรอนอิสระ(delocalised electrons) นี่คือเหตุว่าทำไมอะตอมหรือชั้นของมันยอมให้มีการเลื่อนไถลไปมาระหว่างกันและกันได้ เป็นผลให้โลหะมีคุณสมบัติที่สามารถตีเป็นแผ่นหรือดึงเป็นเส้นได้

ไม่มีความคิดเห็น:
แสดงความคิดเห็น